삼성바이오로직스, 규제기관 제조 승인 300건 돌파
승인
2024-10-10 16:53
김샛별 기자
imfine@kyeonggi.com
기자페이지
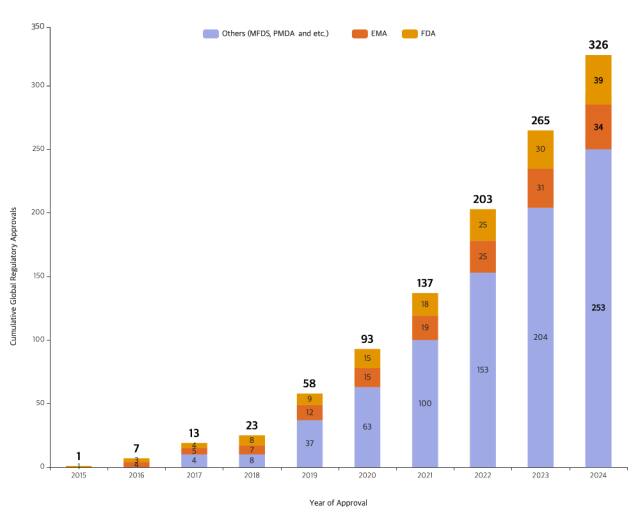
삼성바이오로직스가 제품 허가 기준 글로벌 규제기관 제조 승인 300건을 돌파했다고 10일 밝혔다.
규제기관 제조 승인은 바이오의약품의 제조 및 관리 전 과정에 대해 GMP 및 품질 적합성이 검증됐음을 의미한다. 위탁생산(CMO) 기업이 생산한 의약품을 시장에 출시하기 위해서는 해당 국가 규제기관의 승인이 필수적이다.
삼성바이오로직스는 지난 9월 기준 미국 식품의약국(FDA) 39건, 유럽 의약품청(EMA) 34건 등 326건의 제조 품목 규제기관 제조 승인을 얻었다.
삼성바이오로직스는 이 같은 성과를 위해 지난 2011년 설립 뒤 실사전문팀을 구성해 전문 인력을 양성했다. 또 전자문서 및 전자품질 관리 시스템을 도입, 의약품 제조와 품질관리 기준에 맞춰 데이터를 디지털화하고 실시간 열람할 수 있게 했다. 라이브 버추얼 시스템(Live-Virtual System)도 구축해 비대면 실사 역량을 강화했다.
존 림 사장은 “신속한 규제기관 인증 획득을 통해13년 동안 CDMO 분야에서 빠르게 성장했다”며 “앞으로도 기술 혁신을 통해 고품질 바이오의약품을 공급하겠다”고 말했다.
© 경기일보(www.kyeonggi.com), 무단전재 및 수집, 재배포금지


로그인 후 이용해 주세요